美国疾病与预防控制中心(CDC)表示,进行手清洁是避免生病和预防传染病传播的最重要步骤之一,免洗消毒洗手液必须含有至少60%的酒精,主要是因为含有至少60%的酒精在一般情况下可以杀死大多数已知的微生物。为应对新冠肺炎疫情,大批美国民众近期开始囤积免洗洗手液,洗手液产品在一些洲开始出现短缺。美国CNBC电视台10日报道称,市场研究机构尼尔森的最新数据显示,2月22日至2月29日之间,美国洗手液的总销售额增长313.4%。美国的洗手液已一瓶难求,为了让中国企业生产的洗手液产品尽快进入美国市场,瑞旭集团现将免洗消毒洗手液出口美国的合规要求整理如下。
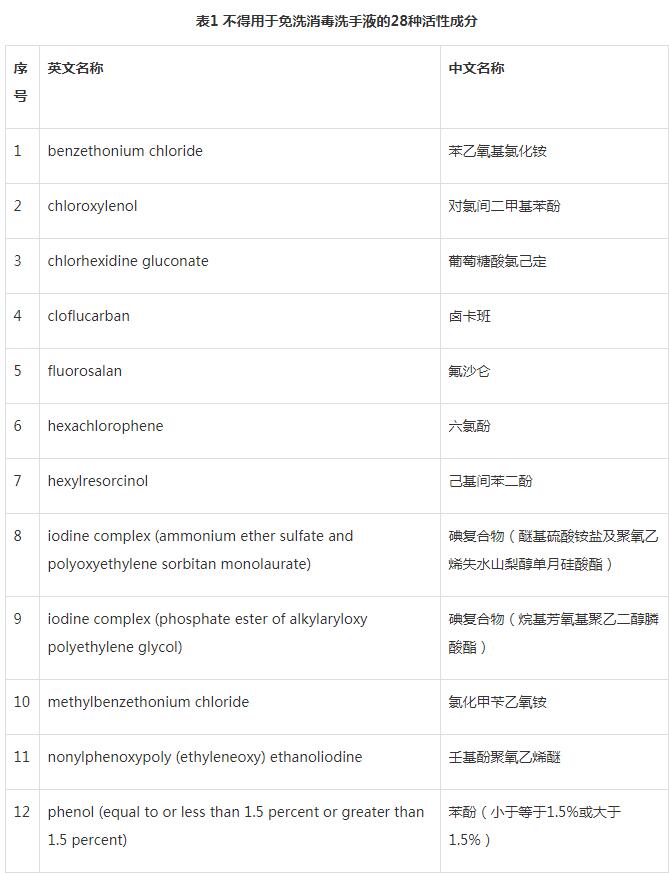
在美国,免洗消毒洗手液属于局部消毒的非处方药即OTC(Over The Counter)药品,由美国食品药品监督管理局(FDA)监管。OTC药品有一套与处方药品完全不同的法规管理系统即“OTC专论”(OTC Monographs)。OTC专论的建立主要分为三步:第一步是由FDA委任的专家顾问委员会评审活性成分,确定是否为安全有效(GRASE)组分;第二步是FDA根据专家委员会的意见、公众意见和新产生的数据,对活性成分进行审查,并发布暂定完成专论(Tentative Final Monograph, TFM);第三步是经过多年使用证明安全有效,发布最终OTC专论(Final Monograph)。OTC专论收录在《联邦管理法》(Code of Federal Regulations:21 CFR parts 331-358)。FDA经过评估,禁止28种活性成分(详细名单见附件1)用于免洗消毒洗手液,主要是因为经检测大多数含有这28种活性成分的抗菌产品,并未能通过OTC药物审查,其中包括苯乙氧基氯化铵和三氯生。
FDA主要审查用于OTC药品的活性成分,若活性成分已经被收录在FDA的OTC专论管理系统内,则其上市销售不需要经过FDA的批准。但生产企业的生产地址应在FDA进行工厂注册,遵守良好生产规范(GMP)和药品登记的相关要求。要按照药品GMP的要求和OTC专论的标准生产,取得美国国家药品登记号(NDC),并且具有符合要求的英文标签,满足美国法规要求的SDS,并符合进出口有关法规要求。上述工作准备好之后,下一步就是进入市场,OTC药品进入市场的途径主要依赖经销商,所以还要求美国境外企业需在美国有自己的经销商。若活性成分没有列入OTC专论系统的话,需要经过FDA审批,申请方式主要有:公民请求(Petition),申报TEA,申报新药申请等。
综上所述,若企业所要出口的洗手液活性成分已列入OTC专论系统,已进行了FDA工厂注册,且该产品符合药品生产质量管理规范(GMP),相对而言合规程序就比较简单,更容易进入美国市场。
瑞旭集团在消毒产品合规领域具有多年的应对经验,在美国、欧洲爱尔兰、韩国等地都有分支机构,可为国内外企业提供中国、美国、欧盟、韩国等国家消毒洗手液合规服务,企业若有需要,可随时联系我们咨询。